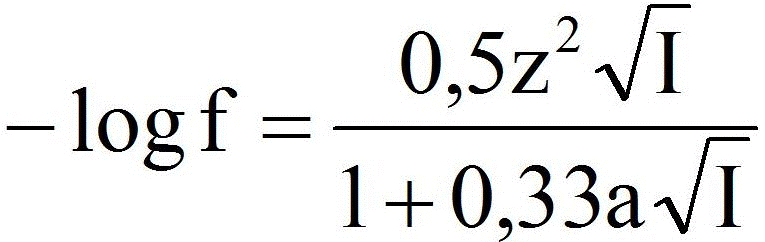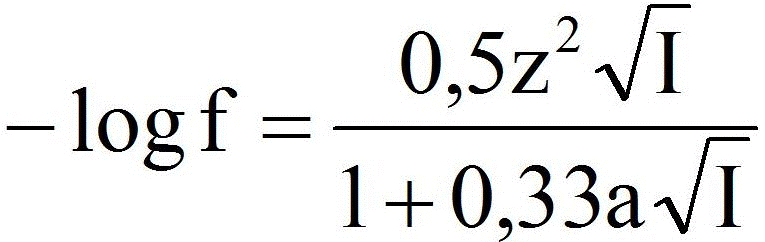Lista 3. - Mocne kwasy i zasady
Zadanie 1. Ile gramów stałego NaOH należy użyć do przygotowania 5 litrów roztworu o pH = 11?
Zadanie 2. Do 1 litra czystej wody dodano 1 kroplę 44-procentowego KOH (ρ = 1,46 g/ml). Ile wynosi pH roztworu (1 ml = 20 kropel)?
Zadanie 3. Roztwór kwasu nadchlorowego o pH = 1,3 rozcieńczano kolejno, aby uzyskać roztwory o następujących wartościach pH: 2; 2,3; 3,3. W jakim stosunku pozostają do siebie objętości otrzymanych roztworów?
Zadanie 4. Zmieszano 175 ml 0,5 mol/l roztworu HClO4 i 325 ml 0,01 mol/l roztworu HCl. Do otrzymanego roztworu dodano 5,6 g stałego KOH. Jakie było pH otrzymanego roztworu?
Zadanie 5. Bezwodnik kwasu fosforowego (P2O5) rozpuszczono w 5 litrach wody. Do zobojętnienia 50 ml otrzymanego roztworu zużyto 60 ml roztworu NaOH (c = 0,1 mol/dm3). Ile gramów bezwodnika użyto do przygotowania roztworu i jakie było stężenie molowe otrzymanego kwasu?
Zadanie 6. W 200 ml roztworu HCl o stężeniu 0,01 mol/dm3 rozpuszczono 112 mg stałego CaO. Obliczyć pH otrzymanego roztworu.
Zadanie 7. 2 g metalicznego wapnia rozpuszczono w 200 ml kwasu solnego o pH = 0,22. Obliczyć pH i pCl otrzymanego roztworu.
Zadanie 8. Zmieszano roztwory NaOH i NaCl w takim stosunku, że w otrzymanym roztworze pCl = 1,7, a pNa = 1,15. Obliczyć pH tego roztworu.
Zadanie 9. 20 ml 63-procentowego roztworu HNO3 (ρ = 1,4 g/ml) rozcieńczono wodą do 800 ml, dodano 40 ml 2 M roztworu NaOH i 160 ml wody. Obliczyć siłę jonową i paH otrzymanego roztworu.
Zadanie 10. Zmieszano 100 ml roztworu HCl (0,5 mol/l) i 200 ml roztworu KNO3 (0,2 mol/l). Obliczyć pH roztworu:
a) bez uwzględniania współczynnika aktywności.
b) z uwzględnieniem współczynnika aktywności (jego wartość odczytać z wykresu).
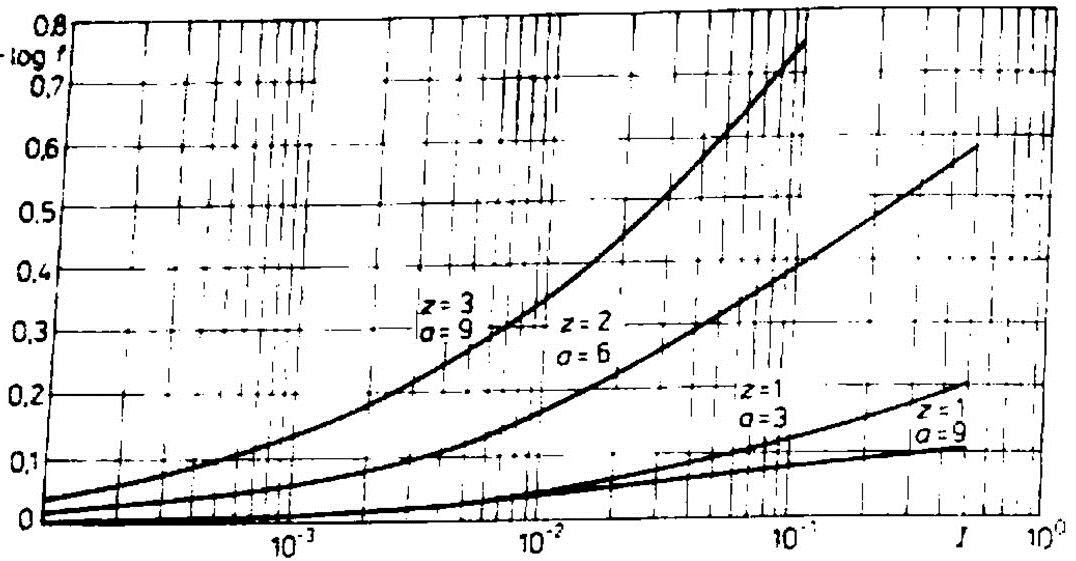
Zależność współczynników aktywności od siły jonowej dla jonu H3O+ (z = 1, a = 9) oraz jonów o ładunku 1 (z = 1), 2 (z = 2) i 3 (z = 3).
Darmowy hosting zapewnia PRV.PL